這篇文章不旨在提供標準答案,而是透過FDA實際核准資料,為您呈現醫材市場最前線的真實動態:看見誰已成功佈局、誰正快速追趕,以及您目前所處的相對位置。
洞察決策關鍵:醫療器材FDA資料的價值何在?
在瞬息萬變的醫材產業中,精準且即時的決策是成功的基石。如果您正在評估下一階段的產品研發方向、潛在的市場擴張區域、偵測主要競爭對手的最新動態,或是篩選具有發展潛力的投資標的,那麼 FDA 最新的 Class II 510(k) 核准資料,將是極具價值的市場情報來源。
這篇文章不僅是對過去一季的回顧,更是一份指向未來發展的市場感測雷達。透過這些資料洞見,您將能探索:
- 哪些產品類型正快速發展,可能改變既有醫材市場版圖?
- 哪些公司——無論是資深巨頭或新進者——展現了強勁的市場准入能力?
- 在熱門的醫材領域中,哪些類別的監管審查相對耗時?
世博研究團隊相信資料會說話。本文將以 2025 年第一季(2025/01/01 – 2025/03/30,以下簡稱2025Q1或本季)FDA Class II 510(k) 的核准資料為分析範圍,提供關鍵資料的客觀呈現與初步解讀,協助您一同掌握最新發展與認知基礎。
欲深入了解這些資料背後更細緻的商業意涵、策略啟示,以及如何轉化為您具體的行動計畫,我們誠摯邀請您參與 2025/5/23 的實體研討會(詳見本文最後段落),現場將有更多獨家分析與深度探討。
一、全景概況:2025Q1 許可證的總體市場信號
- 總計核准 696 項 510(k) 許可證。
- 涉及 576 家 不同的申請人(Applicants)。
- 涵蓋 313 個 各異的產品代碼(Product Codes)。
- 申請人遍佈全球 36 個 不同國家(Applicant Countries)。
這些資料共同描繪了 2025 年開局的醫材產業圖景,預示著技術焦點與市場資源可能的流動與再分配方向。相較於前一季(2024Q4),本季新獲准510(K)許可證、申請人數量明顯下降。
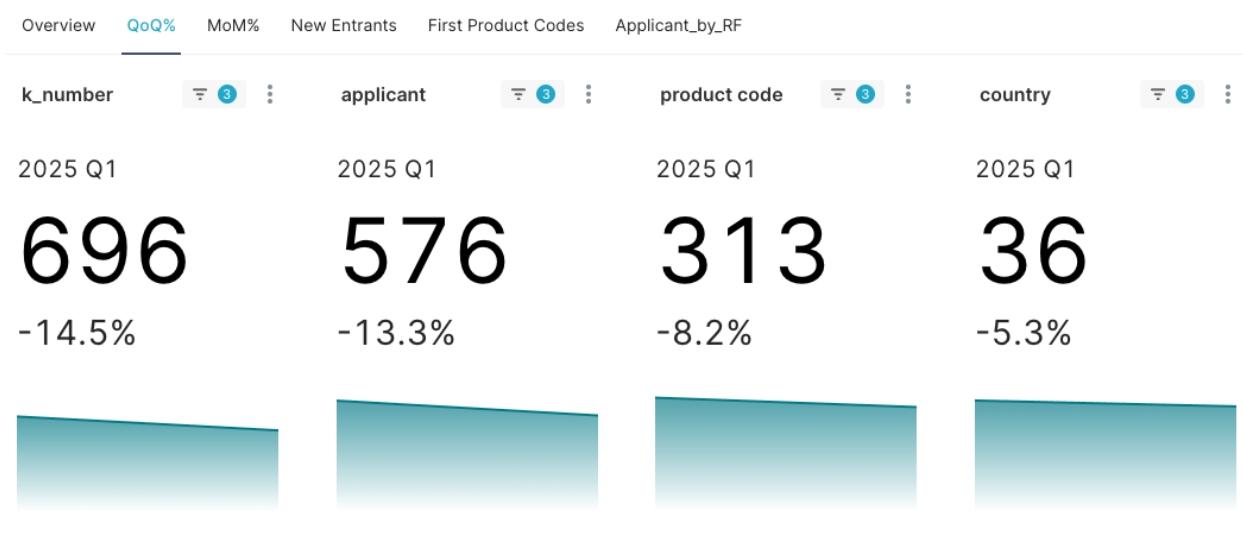
圖1: 2025Q1 FDA Class II新獲准510(K)許可證統計與QoQ%綜覽
二、產品與監管熱點:趨勢何在?審查效率如何?
熱門產品類型分析
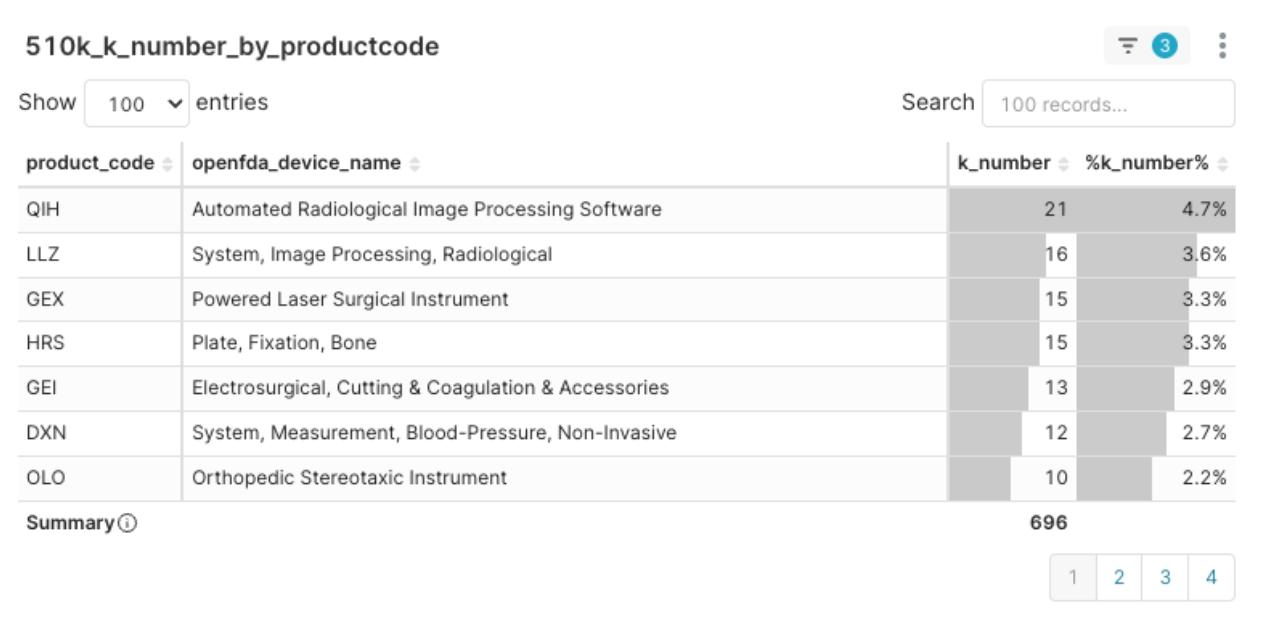
圖2:2025Q1 核准數量 Top Product Code 分布
本季核准數量最多的前五大產品代碼(Prodcut Code)為:
- QIH – Automated Radiological Image Processing Software(自動化放射影像處理軟體, 21 件)
- LLZ – System, Image Processing, Radiological(放射影像處理系統, 16 件)
- GEX – Powered Laser Surgical Instrument(雷射手術器械, 15 件)
- HRS – Plate, Fixation, Bone(骨用固定鋼板, 15 件)
- GEI – Electrosurgical, Cutting & Coagulation & Accessories(電燒與凝血系統, 13 件)
深入分析這些熱門產品代碼的分布與其內涵,我們可以看到以下趨勢::
- 醫材領域的數位化、特別是放射影像分析相關技術,正迅速成為市場與監管的熱點。
- 外科手術緊密相關的設備(如雷射、電燒)依然維持強勁臨床需求與法規審查活力。
- 這些熱門產品代碼通常代表監管路徑相對明確,雖市場競爭可能更為激烈,但也為具備實力的醫材新創公司及其產品提供了較為清晰的進入機會。
熱門不代表審查速度快
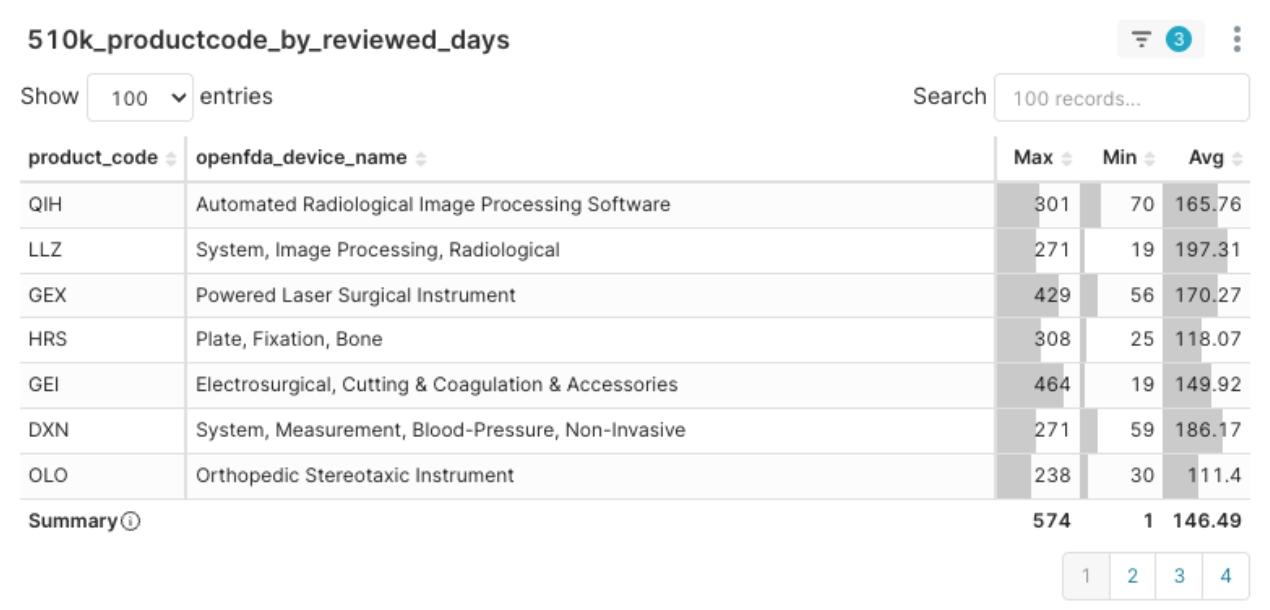
圖3:2025Q1 Product Code 平均審查日長分布
雖然部分熱門產品代碼(如 OLO)顯示出相對較快的審查速度,但不容忽略的是,包括 LLZ、QIH、DXN 等熱門產品代碼,其平均審查時間仍相對偏長(平均約180天左右,其中,韓國Eunsung Global的K233118自申請到獲准甚至長達464天)。這表明產品的市場熱度與其監管審查的標準化或穩定性並非必然同步。在這些領域佈局,需要對審查時程有更保守的預期與更充分的準備。
委員會熱區解析
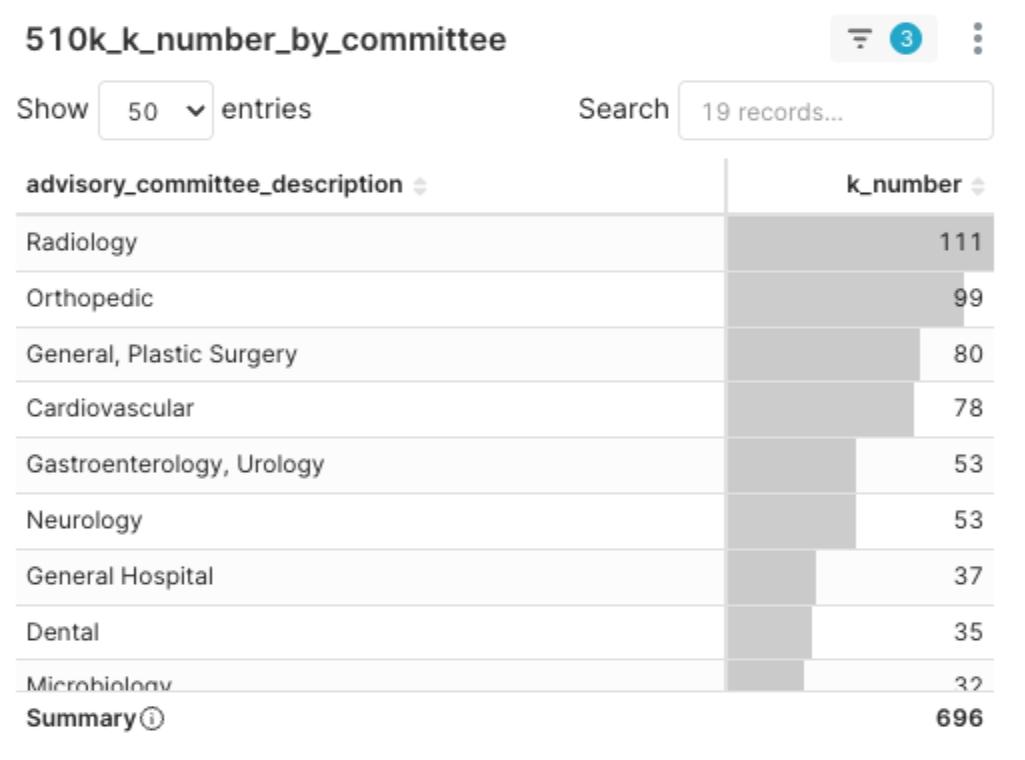
圖4:2025Q1 各委員會核准510(k)許可證分布圖
本季核准數排名前五的 FDA 審查委員會依序為:Radiology(111 件)、Orthopedic(99 件)、General / Plastic Surgery(80 件)、Cardiovascular(78 件)以及 Gastroenterology / Urology(53 件)。
新核准510(k)許可證數量高度集中在這些委員會,提示了幾項關鍵趨勢:
- 這些領域代表著當前醫材市場最為活躍、創新最為密集的區塊,投資與競爭強度同樣高。
- 高核准數量的委員會多是發展較成熟、審查路徑已相對明確的類別。新進入者可以參考既有框架,但差異化是突圍的關鍵。
- 若產品能成功通過這些競爭密集的委員會審查,通常意味著其技術成熟度與法規適應能力已達到領先水準。
創新模式觀察:全新產品類別極少,主流仍是功能延伸
在 2025 Q1 核准510(k)許可證所涉的 313 個 Product Code 中,僅有兩個是在2025年首次出現的全新類別(約佔313個Product Code中的0.6%),分別為:
- SDY – Loss of Pulse Notification Software(申請人:Fitbit),審查耗時:152 天
- PAB – Cytomegalovirus (CMV) DNA Quantitative Assay(申請人:Hologic),審查耗時:28 天
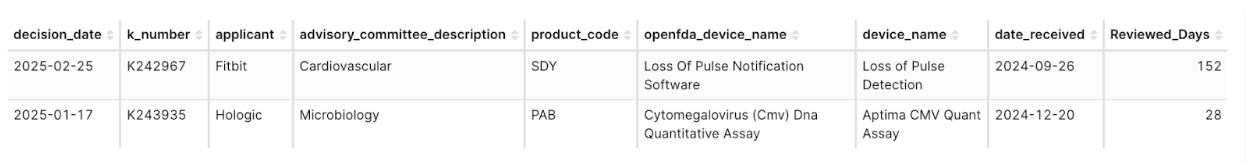
圖5:截至2025Q1才首次核准 510(k)許可證的Product Codes: SDY及PAB
這項資料顯示,當前醫材產業510(k)許可證的多數創新,傾向於在既有產品類別框架內進行功能擴展、性能提升或應用轉譯,而非開創全新的產品定義。
對於醫材品牌而言,這意味著沿用現有 Product Code 可能加速法規流程;對於新創公司,選擇成熟分類能降低法規不確定性。
然而,對投資人而言,雖然全新類別風險較高,但一旦成功,具備定義市場的巨大潛力,是值得深入研究的投資標的。例如:於本季首次核准510(k)許可證的產品代碼PAB,即Hologic 的 K243935 許可證核准了 Aptima CMV Quant Assay,用於移植病患的巨細胞病毒 (CMV) DNA 定量。此 Special 510(k) 案證明與其Predicate Device (為同一申請人於2022年核准的PMA許可證P210029) 實質等效,僅約 28 天即獲准,遠快於 FDA 90 天目標,顯示申請文件完備且變更未增安全疑慮。
三、申請人動態:誰是新起之秀?誰持續領先?
國家分布洞察:亞洲勢力抬頭
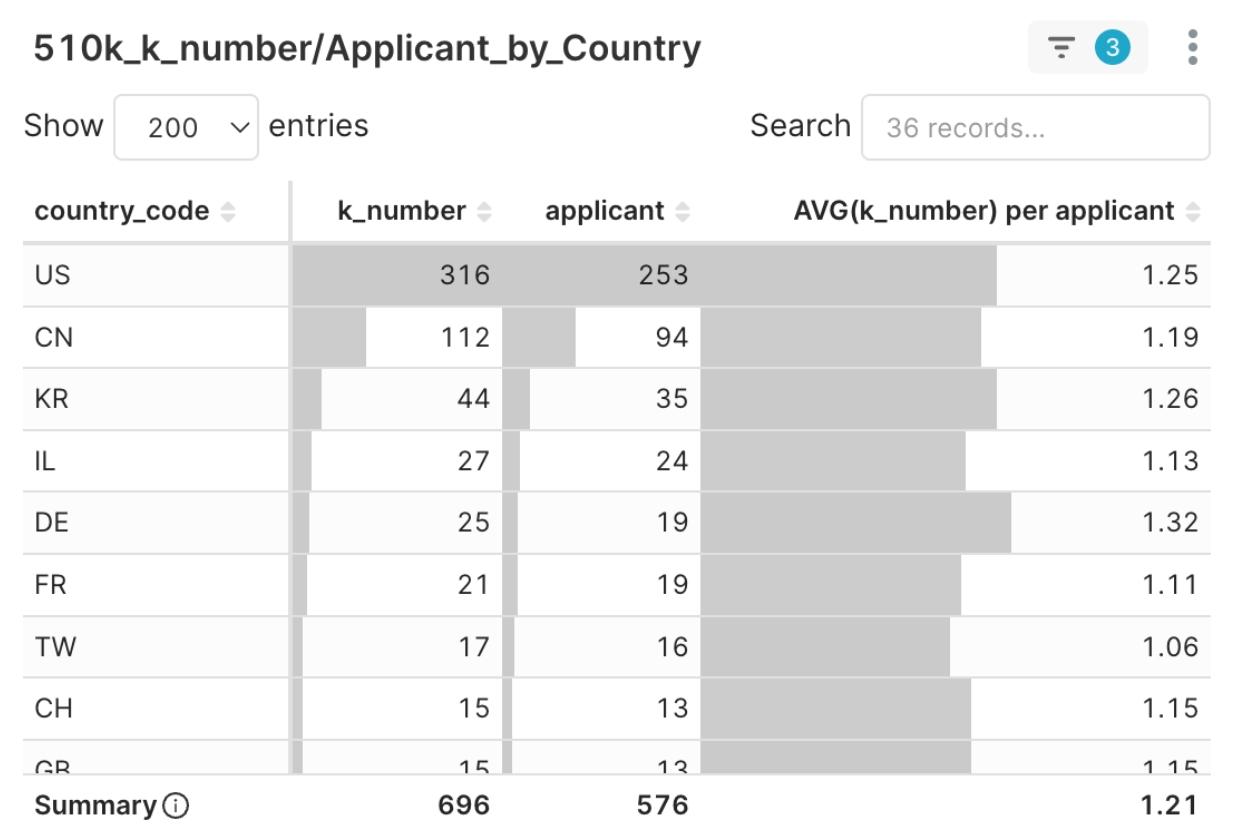
圖6:2025Q1 核准 510(k) 與申請人所屬國家分布圖
2025 Q1 核准的 510(k) 許可證來自全球 36 個國家。其中,美國(US)仍以 253 家申請人、共 316 件核准佔據絕對主導地位。相對地,美國以外的35個國家合計323申請人,佔申請人比例約55%。
值得注意的是,亞洲國家的表現日益突出:
- 中國(CN)以 112 件核准位居第二,強烈反映中國醫材企業積極佈局美國市場的企圖。
- 韓國(KR)以 44 件緊追在後,躍居第三大來源國。
- 此外,日本(JP)雖然申請人數量相對較少(6 家),但平均每家公司取得 2.17 件核准,效率高於其他主要國家,顯示其在法規準備方面的競爭優勢。
這些觀察為有意進行跨境合作、併購或市場拓展的企業與投資人提供了重要的參考維度,亞洲申請者的動能與策略值得關注。
新進者可圈可點:四分之一的申請人是市場新面孔
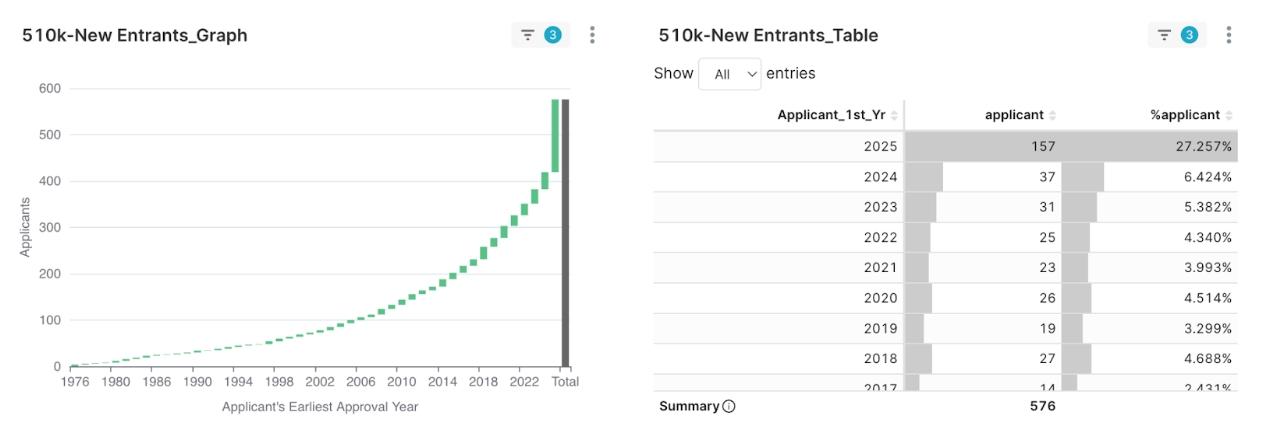
圖7:2025Q1 核准 510(k) 之申請人首次取證年份佔比
在 2025 年第一季所有獲得 510(k) 核准許可證的申請人中,有高達 157 家(佔總數的 27.3%) 是首次在 FDA 許可證紀錄中出現的「New Entrants」(新進者),這代表本季每四家取得許可證的公司中,就約有一家是第一次成功進入美國市場。
特別值得關注的是,首次取得許可證的5個申請人中,美國的Boston Aesthetics Inc、中國的Guangdong Xinyu Electronic and Technology Co., Ltd.及Guangzhou Potent Medical Equipment Joint-Stock Co., Ltd.、加拿大的Inbella Medical Ltd.、義大利的Medical Microinstruments, Inc.,在 2025 Q1 各自取得了 2 項510(k)許可證,展現出強大的初登場動能以及在技術開發與法規策略上的成熟度。深入了解這些新進者的背景、技術方向與成功策略,將有助於判斷潛在的合作、投資或競爭機會,這部分更細緻的案例分析,也將是我們 5/23 研討會的重點內容之一。
經驗輪廓雷達圖:辨識夥伴與對手
分析申請人的歷史許可紀錄,我們發現了幾種類型的「經驗輪廓」:
- 穩定型老將: 如 Medtronic(自 1981 年起,累積 45 年經驗)、Zimmer(50 年)、Smith and Nephew(46 年)等,持續穩定的每季提交申請並獲得核准。他們是市場深耕的代表,也是尋求併購或策略合作的關鍵對象。
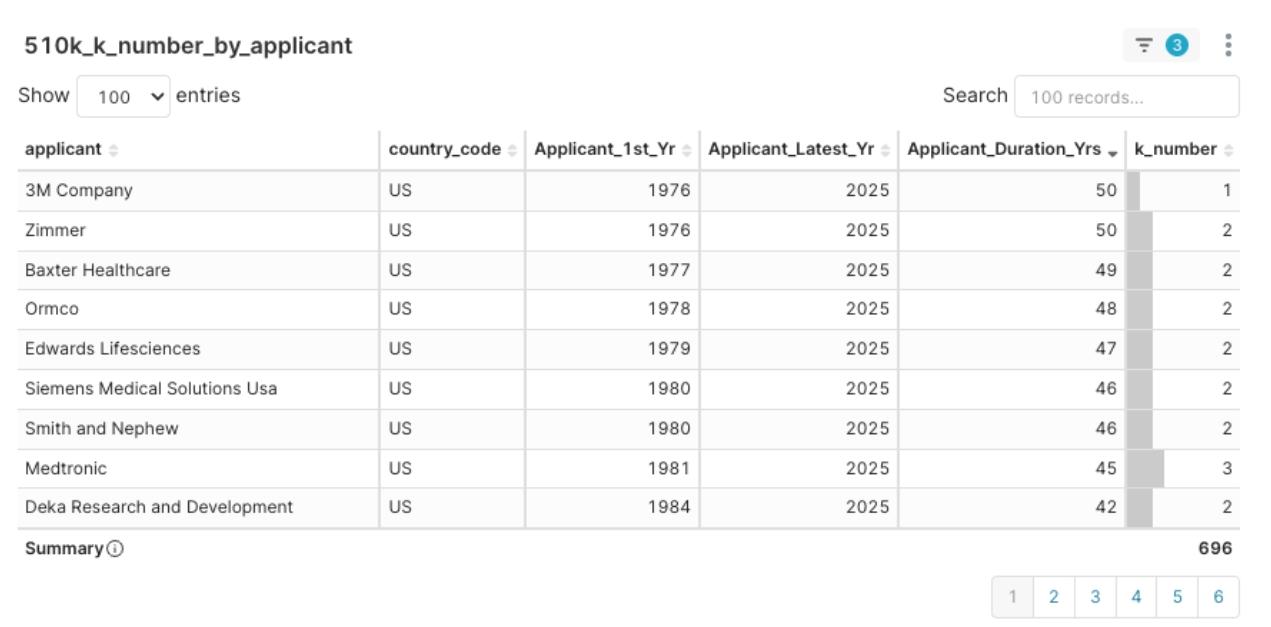
圖8:2025Q1 申請人核准經驗分布圖,以經驗年數降冪排序
- 活躍型成熟者: 如 Arthrex(34 年經驗,本季提交 9 案)、Stryker、Varian 等,具備豐富經驗且在當季表現活躍,透過多管齊下方式推進產品。他們是主要的市場競爭者,同時也可能是潛在的研發夥伴。
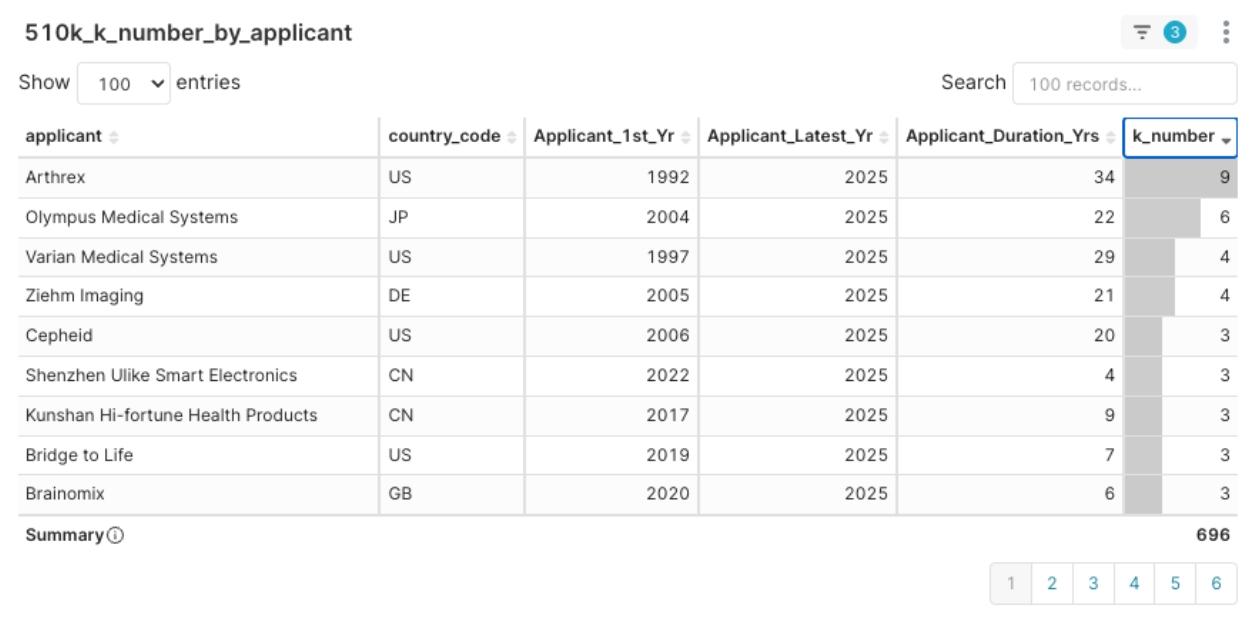
圖9:2025Q1 申請人核准經驗分布圖,以k_number降冪排序
- 新進高密度型: 如前述的 Medical Microinstruments、Boston Aesthetics,雖然是2025 年才首次取得許可,但在 2025 Q1 即展現高核准效率。他們代表了高潛力的新興力量,可能需要策略性的介入(如投資或合作)來共同開拓市場。
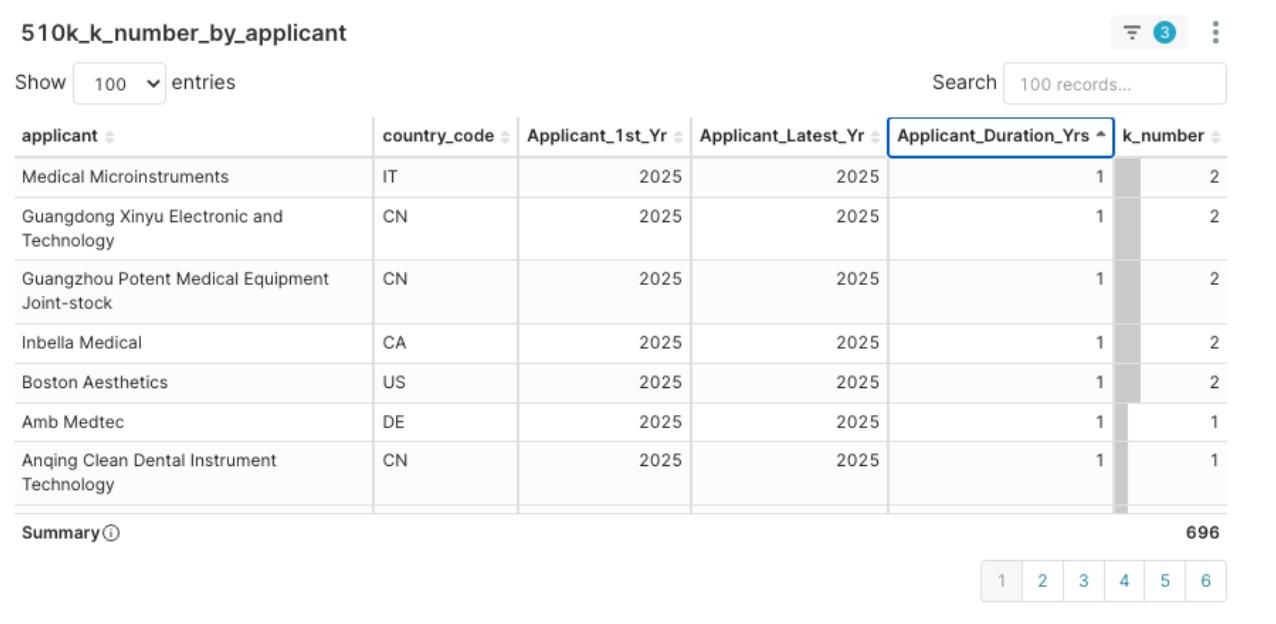
圖10:2025Q1 申請人核准經驗分布圖,以經驗年數升冪排序
這份結合「經驗深度」與「近期活躍度」的視角,能幫助醫材品牌與投資人快速辨識潛在的合作夥伴是否具備穩定的審查節奏、對手的法規熟悉度,或是具備高潛力但仍在成長階段的新進創新者。
四、資料為您量身打造:不同角色的策略視角
綜上所述,基於 2025 Q1 FDA 510(k) 的許可證情報洞見,可據以支持醫材產業不同角色採取的策略行動重點,例如:
- 對醫材品牌而言:
- 辨識競品方向與新興玩家的動態。
- 優化產品法規路徑及其市場定位。
- 評估研發或投資併購之潛在對象。
- 對新創公司而言:
- 確認產品是否屬熱門類別並評估競爭度。
- 深入了解特定類別審查效率及監管難點。
- 積極尋找具備法規經驗或通路合作機會。
- 對投資者而言:
- 聚焦首次核准具高效率潛力新進公司。
- 評估具穩定核准記錄之成熟公司標的。
- 避開審查變異性高或前景不明朗類別。
結語:情報是起點,行動是關鍵。您準備好領先一步了嗎?
當您深入閱讀這份基於 2025 Q1 FDA 510(k) 許可證資料的分析,或許腦中已開始浮現一連串與自身業務或投資策略相關的問題:
- 我的主要競爭對手是否也剛透過新產品取得了上市許可證?
- 我目前開發的產品是否恰好落在審查周期最長或競爭最激烈的熱區?
- 有哪些國家或公司正積極佈局美國市場,是值得關注或潛在合作的對象?
這些問題本身,就是策略思考與下一步行動啟動的最佳起點。資料提供了市場的真實影像,但如何將這些影像轉化為競爭優勢,則需要更深入的洞察與策略規劃。
📅 如果您渴望搶先一步,不僅看懂資料,更能掌握這些資料背後的商業邏輯、挖掘未公開的獨家洞見,並學習如何將其轉化為您醫材事業或投資組合的具體策略與行動方案,請立即報名參加 5/23【掌握醫材發展機遇,成就非凡未來】實體研討會。
現場將由世博團隊提供:
- 未公開的資料交叉分析: 例如特定類別的詳細申請/核准率、不同公司類型的平均審查時長比較等。
- 成功案例深度解讀: 分析本季表現亮眼的新進者或高效率公司,學習其法規策略。
- 互動問答與交流機會: 直接與產業專家交流,針對您最關心的資料或趨勢提問。
- 第一手的市場策略建議: 結合資料洞見,為企業和投資人提供更具體的決策參考。
席位有限,立即報名,為您的醫材策略搶佔先機!

