摘要 Summary
延續 Wispro RFM 系列分析脈絡,本報告分析 2025 年第三季美國 FDA 所核准的所有 Class II 510(k) 案件。
透過IXI MedTech智慧平台,本文從申請者行為、審查時程效率與新產品代碼生成趨勢等觀點進行觀察,揭示監管學習與資料洞察如何形塑 MedTech 產業競爭力。
執行摘要
總量穩定,訊號更清晰
2025 年第三季共有 753 件 510(k) 核准,由 595 家申請者提交,橫跨 344 項產品代碼、32 個國家。平均審查時程約 143 天。
成長動能來自新進挑戰者
166 家(約 28%)為2025年首次取得 510(k) 的申請者;若含 2023–2025 間首次取得者,比例達 40%,顯示醫材新進企業快速成熟。
「2–5 次核准」申請者審查效率優勢
中階申請者(成長耕耘者)審查速度快於初次獲准者、略慢於已獲准超過 6 次以上老手;該審查時間差距即為可量化的機會成本。
8項新產品代碼誕生,重劃醫材市場邊界
橫跨放射、神經、心臟、麻醉、免疫與臨床化學六大領域。
IXI 理念:從資料霧中提煉清晰洞察
世博在本文中體現 IXI MedTech 的核心使命——
以資料驅動 (Data-Driven) 的方式,將 FDA 開放資料轉化為可行決策情報,協助 MedTech 領導者從「認知 (Cognition) → 決策 (Decision) → 行動 (Action)」。
我們刻意不再製作例行的排行榜,而專注於具證據鏈的非顯性模式。
IXI 透過嚴謹的資料關聯與行為分析,呈現那些他人難以複製的洞察。
1. 誰在取得 510(k) 核准 — 新進與回流申請者
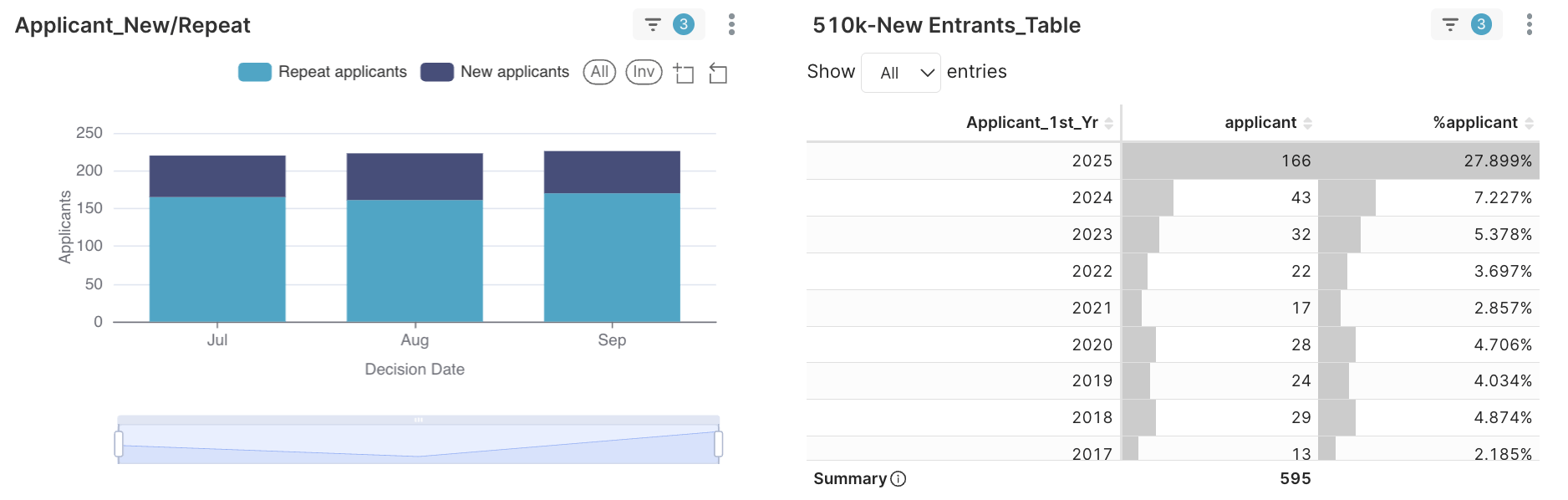
圖 1. 595家申請者中,有166家 (約28%) 於2025年首次取得510(k).
事實
- 595 家申請者中,有 166 家(約 28%)首次取得 510(k) 核准。
- 約 40% 的 Q3 申請者於 2023–2025 年首次取得510(k)(2025:28%、2024:7.2%、2023:5.3%)。
FDA Class II 生態系展現「成熟與滲透並存」,資深申請者與新進者不僅共存,且值得注意部分積極展現企圖心的新進者多已準備下一次送件。
洞察要點
- 高比例新進者=市場持續更新。
- 重複申請者=技術聚焦與商業動能。
- 多元化申請者組成,有助於投資與監管環境共榮。
角色啟示
- 品牌商 → 關注同代碼下的重複申請者,預測價格與毛利壓力。
- 新創 → 設定標竿審查天數目標,善用首次獲准經驗,加速第二案申請準備。
- 投資者 → 追蹤跨越首次獲准的年輕醫材公司,作為執行力早期信號。
2. 經驗如何影響審查時程 — RFM 模型觀點
範圍說明
本分析聚焦 2025 Q3 核准案件,每位 Applicant 的 R (Recency,Applicant_Idle_Yr)=0–3 年;
以 F (Frequency,Applicant_Approvals) 分群:1、2–5、6+。
(方法論與細節可參考:發掘FDA 510(k)資料潛能-RFM模型驅動醫材產業成長決策新思路,2025年5月)
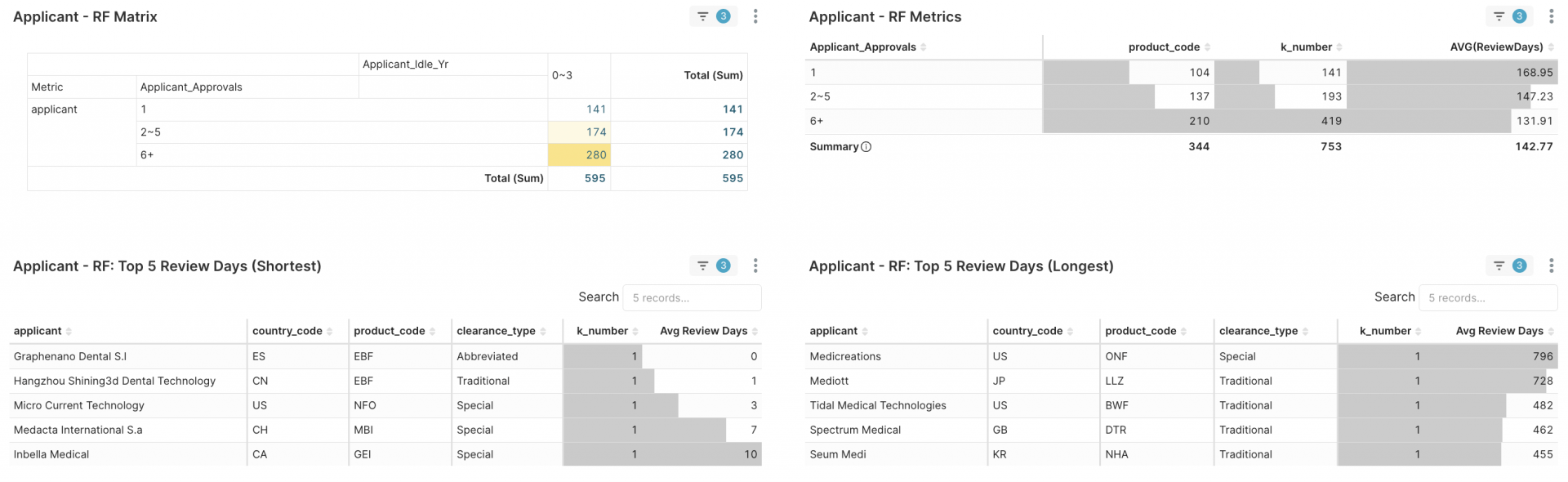
圖 2. 申請者之獲准510(k)經驗區間及其平均審查天數比較
事實
- 2–5 次核准群組的審查時程平均短於首次申請者,但略慢於 6+ 群組;這代表這群申請者,已經跨越初次獲准510(k)許可證的鴻溝,正在從學習曲線過渡到效率高原,兼具熟悉度與敏捷度。
由於醫療器材必須獲准FDA核發的許可證,才能開始行銷和銷售,換言之,每延遲一個月的審查天數,相當於一個月的營收機會損失。
為什麼我們要同時顯示「前五名最短/最長審查天數」表格?主要目的用於協助醫材品牌商、新創了解基準錨點(benchmark anchor),據此設定新申請510(k)許可證的審查天數目標。如果您的審核速度比同等審核類型和複雜程度的同業慢,那麼您將損失數月的市場時間。
洞察要點
- 2–5 次核准=監管學習的甜蜜點。
- 審查週期差異可預測商業急迫性。
- 最短/最長審查天數資料作為標竿基準。
角色啟示
- 品牌商 → 以 2–5 次獲准群組平均審查時程作為內部效能對標。
- 新創 → 參照相同或類似領域成功獲准510(k)模板,快速進入高效率區間。
- 投資者 → 優先關注 2–5 次獲准群組的醫材企業,因其兼具規模化潛力與執行紀律。
3. 新產品代碼揭示的邊界變化 — 創新、法規、市場
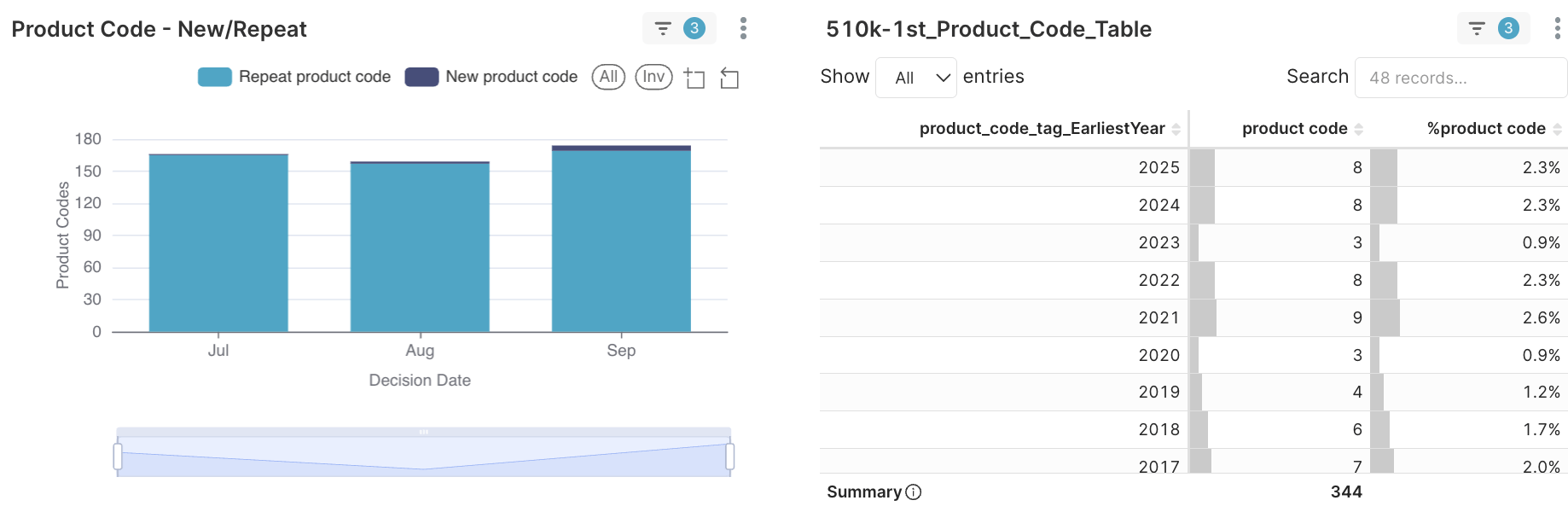
圖 3A. 於2025Q3首度獲准/重複獲准510(k)的產品代碼(Product codes)數量分布
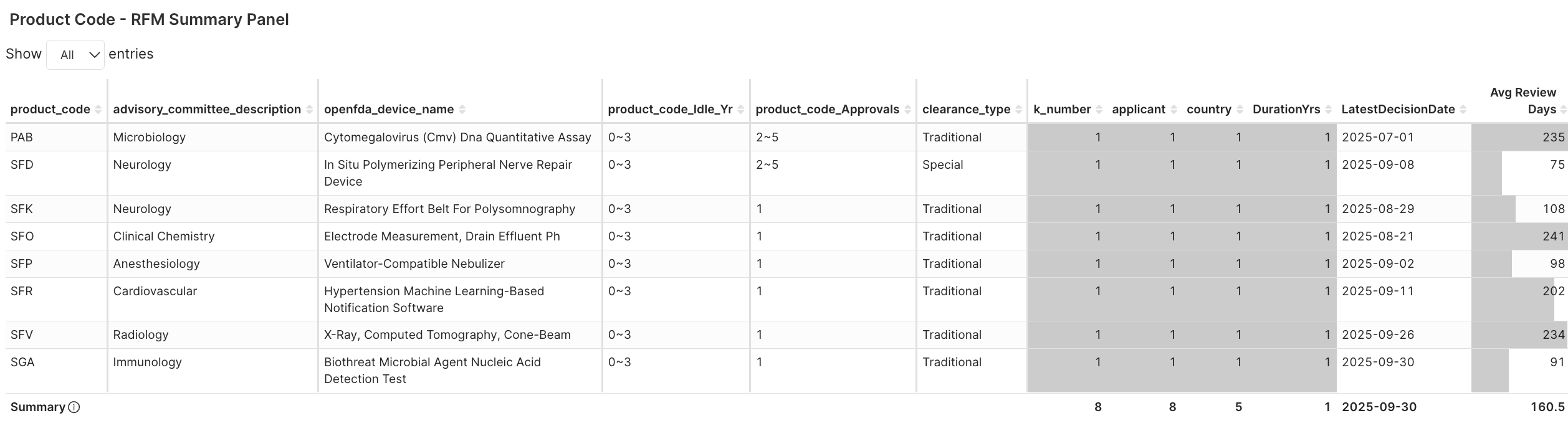
圖 3B. 於2025Q3首度獲准510(k)而非De Novo的8項產品代碼
事實
- 在 2025 年第三季,有八項產品代碼首度於 510(k) 核准途徑出現(非經 De Novo 途徑)。
- 這些新代碼涵蓋放射科學、神經學、心臟學、麻醉學、免疫學與臨床化學。
洞察要點
- 新產品代碼獲准許可證,重繪了醫材市場定義以及保險給付邏輯。
- 以比對基準裝置 (Predicate device) 為核心的510(k)醫材創新仍為主流。
- 產品代碼監管分類本身已成為市場邊界的潛在定義者。
角色啟示
- 品牌商 → 即時調整標籤與聲明,以符合法規新產品分類代碼。
- 新創 → 評估並利用新產品代碼,作為快速跟隨者的市場切入點。
- 投資者 → 新產品代碼代表未被定義的新市場和新價值,為未來的投資機會。
(交叉參考:2025 Q2 FDA數據解析:AI影像軟體熱度攀升,市場競爭格局浮現,2025年7月)
4. 洞察先機 — 串聯法規情報到市場影響
儀表板和圖表雖可揭示數十項描述性指標,而本文將帶您更進一步 —— 探索資料中的隱藏規律,如何轉化為策略性的契機。
在此,我們將透過兩個簡短的實證故事,邀請您一同體驗 IXI 的設計理念,及其以洞察驅動 (insight-driven)的旅程,從辨識信號到採取商業行動。
故事 A:快速跨越鴻溝(Crossing the Chasm Fast)
探討新進申請者如何在短短數年內,從取得首次 510(k) 許可,迅速發展到獲得多項核准——以及這對競爭者、合作夥伴與投資人所代表的意義。
故事 B:從 510(k) 到開創新疆界
剖析創新者如何透過全新的產品代碼取得 510(k) 許可,從而重塑既有市場類別——揭示這些看似「漸進式」的申請,實際上如何重新定義市場。
每個故事都將多個圖表串聯成一條洞察鏈 —— 依循「事實 → 解讀 → 影響」的脈絡推進——並在結尾探討不同醫療科技(MedTech)領域的專業人士下一步能採取什麼行動。
故事A:快速跨越鴻溝
儀表板分析路徑
1. Applicant RFM > Applicant RF Matrix → 聚焦2–5件 (174公司)
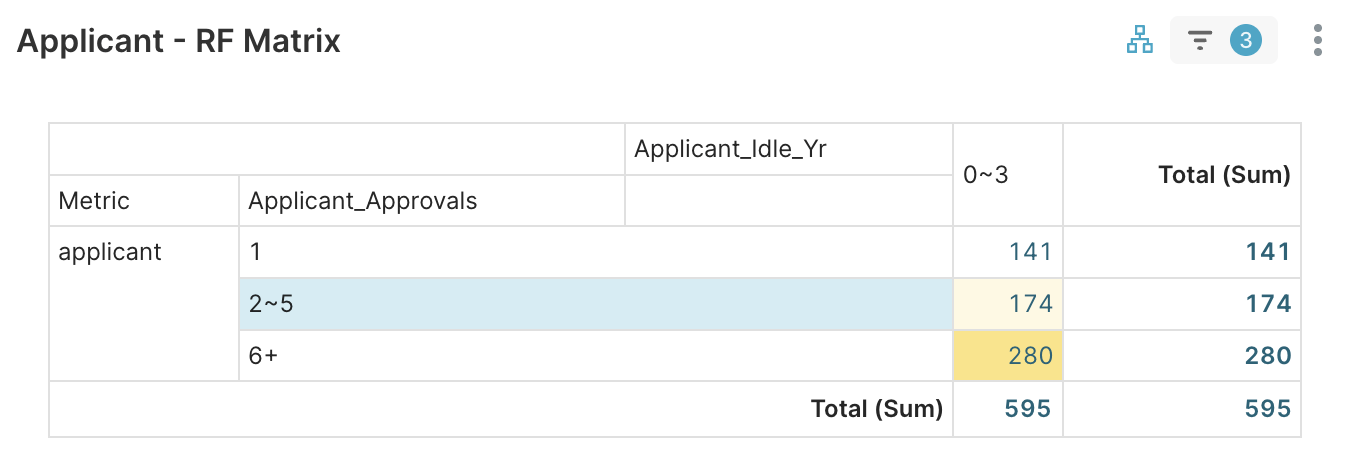
圖 4A. 篩選「核准數 (Applicant_Approvals)」為 2~5 件
2. New Entrants > Applicant 1st Year → 依申請者首次獲准年份顯示分布
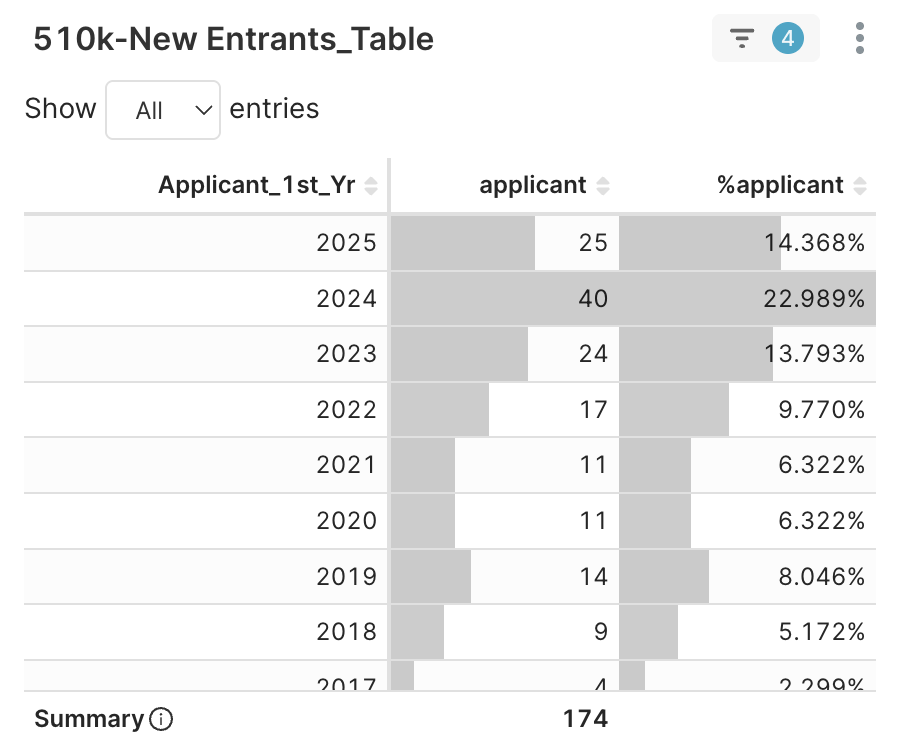
圖 4B. 174 家申請者 (核准數 2~5) 依首次獲准年份分佈。
深入探究這 174 家公司,其中 89 家 (約 51%) 是 2023 年後才首次獲准,卻能在三年內取得多項 510(k) 許可。這些申請者是誰?點選任一「首次獲准年份」(例如 2025),繼續下一步。
3. Applicant RFM > Applicant RFM Summary Panel → 公司層級的基準比較。 如下表所示,這些是快速成熟的年輕申請者範例。
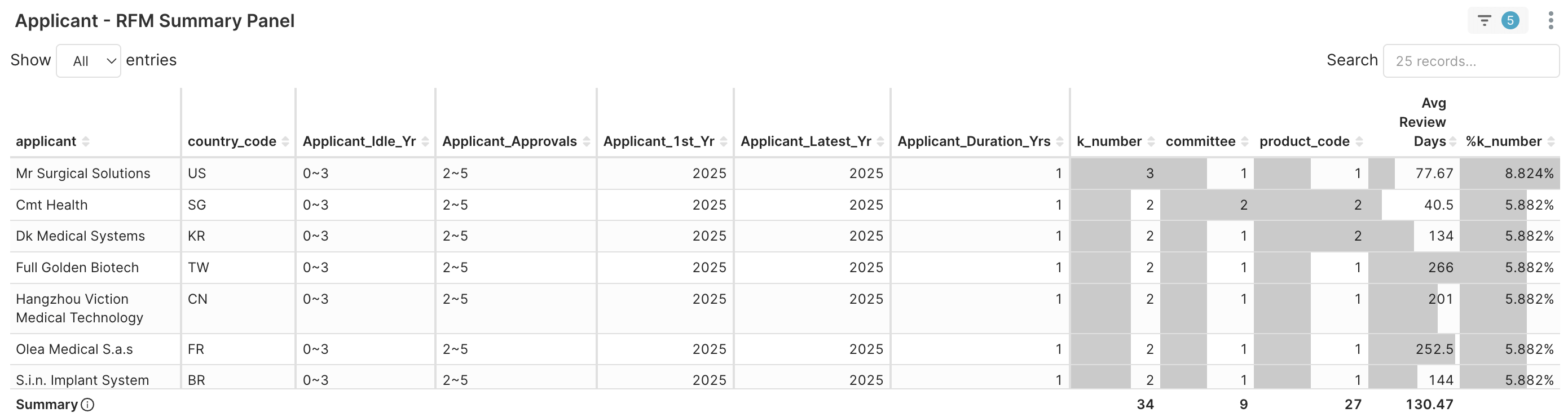 圖 4C. 首次獲准年份為 2025 年的部分申請者 (核准數 2~5)
圖 4C. 首次獲准年份為 2025 年的部分申請者 (核准數 2~5)
洞察要點
- 這些快速成熟的年輕公司在三年內,便從首次獲准推進至取得多項許可。這證明了「結構化的法規學習」是提升市場速度的關鍵。這個群體代表了已學會法規應對策略,但尚未擴展到應對高度複雜性的公司——這是一個兼顧敏捷與紀律的「效率高原期」。
- 這些快速成熟的新進者表明,公司一旦突破首次獲准的關卡,後續的進程將顯著加快——這意味著他們已具備了持續創新的能力。
角色啟示
- 品牌商 → 敏捷的新進者正在壓縮市場領先者的優勢週期。
- 新創 → 標準化510(k)可重複模板,以加速規模化。
- 投資者 → 能在 36 個月內取得 2-5 項許可,代表具備相對突出的營運紀律。
故事B:從 510(k) 到開創新疆界
儀表板分析路徑
1. First Product Codes > 510k-1st_Product_Code_Table → 選擇最早年份 = 2025 (共 8 個新代碼)
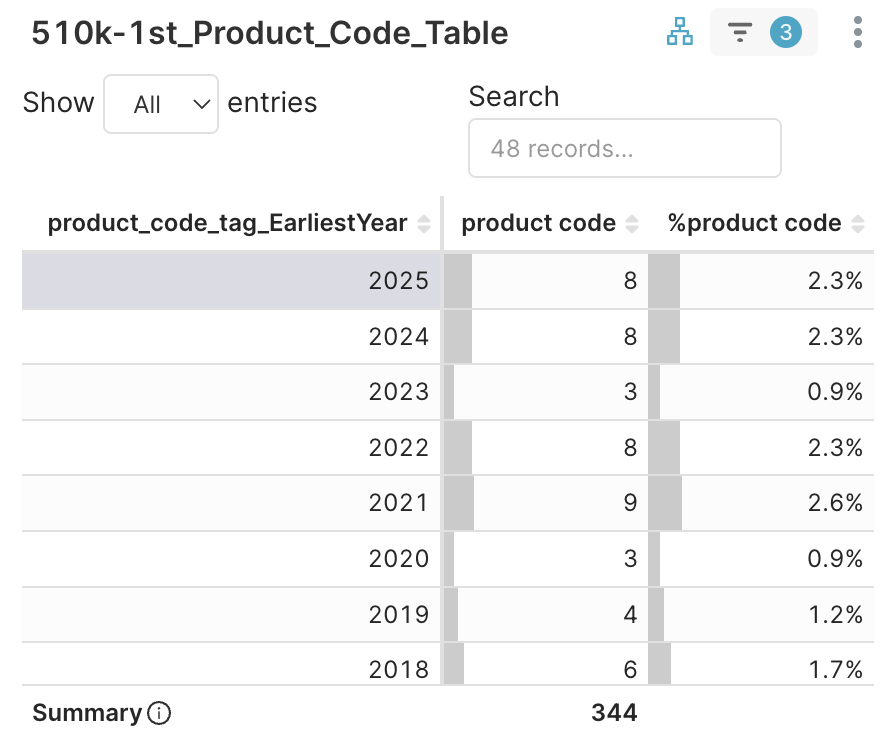
圖 4D. 於 2025 年 Q3 取得許可的新產品代碼及其最早獲准年份
2. Applicant RFM > Applicant – RF Matrix → 八家橫跨不同經驗光譜 (1 次、2-5 次、6 次以上) 的申請者,成功透過新產品代碼拓展了法規的邊界。
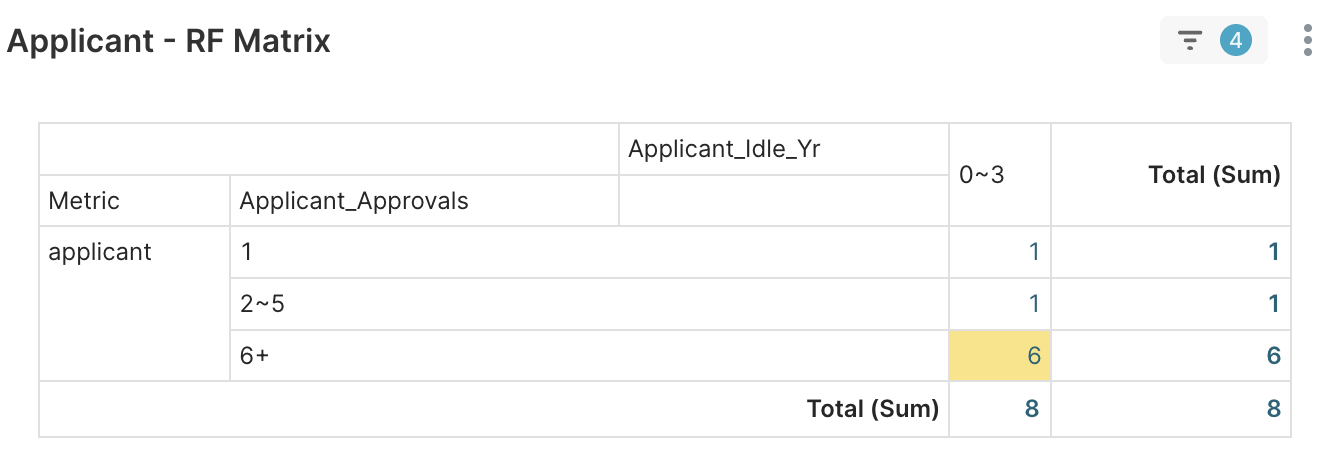
圖 4E. 八家具有不同核准經驗的申請者
3. Applicant RFM > Applicant RFM Summary Panel → 查看這些申請者的身份及其法規特徵 (例如:首次獲准年份、核准次數與歷時)
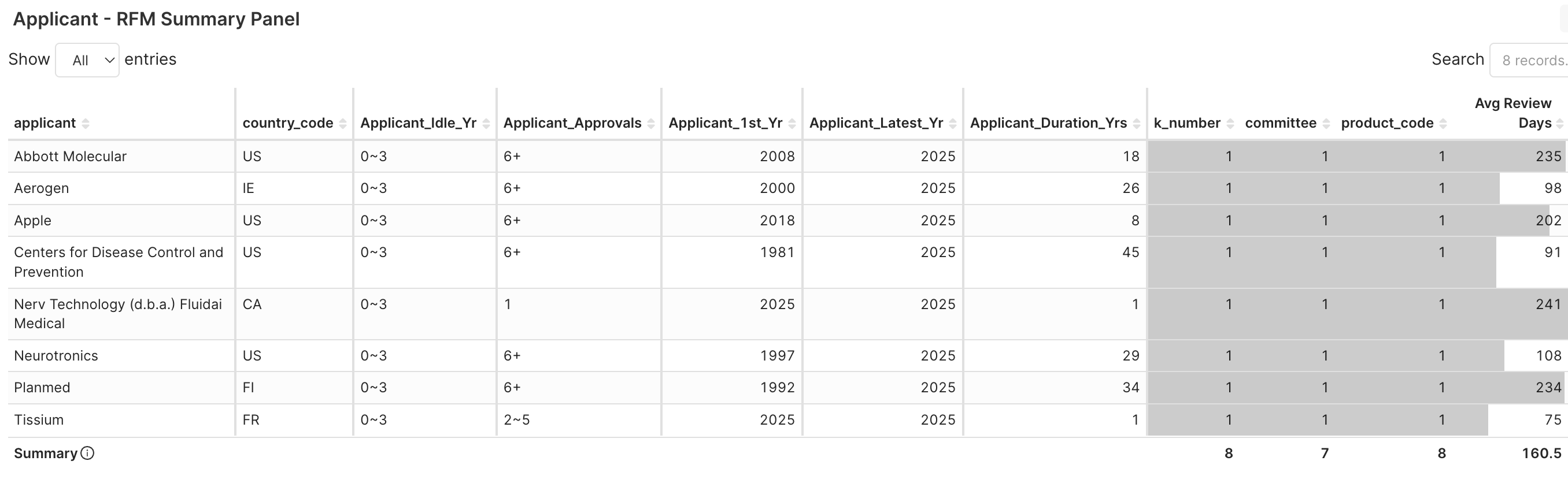
圖 4F. 八家取得新產品代碼許可的申請者
4. Clearance Detail → 在此分析中,我們從核准經驗光譜的兩端,分別挑選了兩個樣本 (Apple 和 Nerv Technology/Fludai Medical) 進行比較。
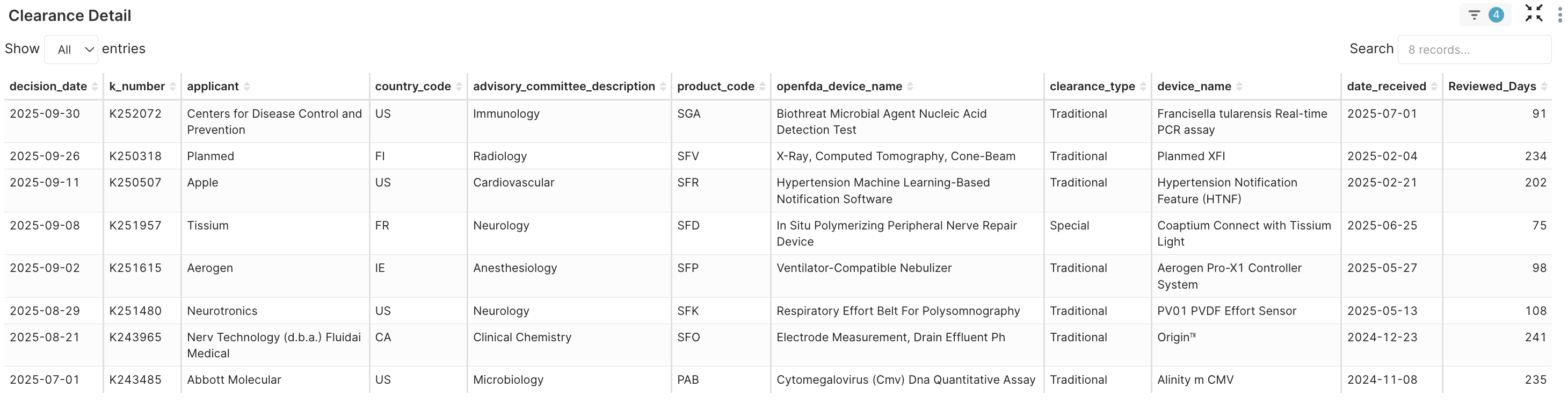
圖 4G. 八個新產品代碼的許可詳細資料
5. 查核背景資訊 → 為驗證內容,我們使用k_number在美國 FDA 網站上查閱 510(k) 摘要 PDF 及相應的產品代碼資訊。
案例 1 – Apple Inc. (美國) | 申請核准數 = 6+
一家資深的科技巨擘正深入受監管的醫療科技領域,將其生態系擴展至健康監測。FDA 決定在 510(k) 途徑下創建一個新產品代碼 (而非 De Novo),這顯示了跨界的大型企業如何在現有框架內,將新類別正式化。
K Number: K250507
Device: Hypertension Notification Feature (HTNF) for Apple Watch
Indication for Use: AI analyzes PPG data to detect hypertension patterns (advisory).
Product Code: SFR – Hypertension Machine Learning-Based Notification Software
Predicate: Viz.ai Viz HCM (DEN230003, QXO)
實質等同性邏輯 (Substantial Equivalence Logic):
-
-
- 預期用途與引用器材 (Viz HCM) 相似,皆為 AI 心血管訊號分析與用戶通知。
- 技術特性不同 (PPGvs. ECG),但效能基準與軟體驗證支持其等同性。
-
為何在 510(k) 下產生新產品代碼:
-
-
- FDA 將 Apple 的 SE 核准信從 QXO 重新分類為 SFR (21 CFR 870.2380),為「機器學習型心血管通知軟體」建立了一個新類別。
- 此類別與傳統器材不同,它分析的是數據趨勢,而非直接擷取生理參數。
- 由於存在 De Novo 分類的引用器材 (DEN230003),Apple 得以循傳統 510(k) 途徑,無需重新提交 De Novo。
-
Takeaway: 新的分類源自於先前的 De Novo 器材,使得後續的 510(k) 申請能使用這個新創的產品代碼。Apple 成功在體制內開創「軟體定義的心血管監測」新類別。

圖 4H. 產品代碼: QXO vs. SFR
案例 2 – Nerv Technology (Fluidai Medical, Canada) | 申請核准數 = 1
一家新進者,成功為其智慧體液監測系統定義了新的產品邊界。此次獲准證明,即使是首次申請者,只要將新的數位功能與現有的法規邏輯結合,也能開創新的市場區隔。
K Number: K243965
Device: Origin™ Continuous pH and Flow Monitoring System
Indications for use: Continuous pH/flow measurement of peritoneal drain effluent (non-diagnostic).
Product Code: SFO – Clinical Chemistry Analyzer for Drain Effluent
Predicate: Radiometer ABL835 FLEX analyzer (K110416, CHL) + pH probe
實質等同性邏輯 (Substantial Equivalence Logic):
-
-
- 臨床目的相同:提供 pH 數據供決策,且風險/控制措施明確。
- 樣本基質 (腹膜引流液 vs. 血液) 與連續使用方式不同,但已透過驗證研究處理。
-
為何在 510(k) 下產生新產品代碼:
-
-
- FDA 認定,在引流管中連續測量 pH/流量,與實驗室的定期檢測是不同的使用情境。
- 因此,FDA 設立了 SFO 產品代碼,用於歸類在照護點 (point of care) 分析非血液流出物的器材。
- 由於其風險和控制措施與現有的血液氣體分析儀相似,且實驗室測試證明了效能等同,因此該申請符合 510(k) SE 資格,而非 De Novo。
-
Takeaway: 即使是基於傳統技術建立 SE,新的樣本基質或臨床情境仍會促使 FDA 產生新的產品代碼。
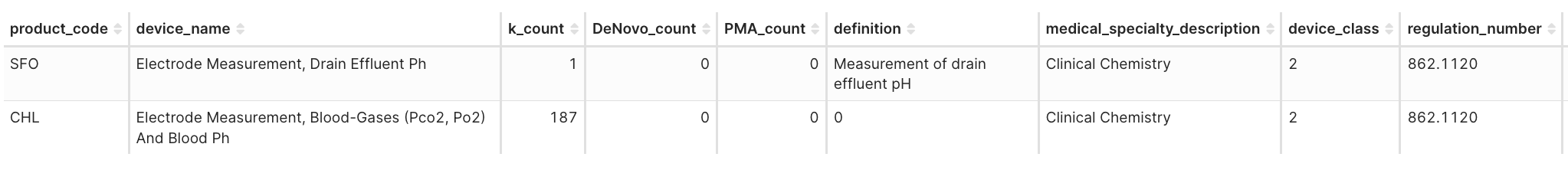
圖 4I. 產品代碼: CHL vs. SFO
洞察要點
- 這兩個案例共同證明,新產品代碼的出現並非法規流程的偶然——它們是醫療科技開拓新興疆界的正式里程碑。
- 這突顯了無論是新創公司還是成熟品牌,只要熟悉法規並提出精確的等同性論證,就能從內部重新定義市場。
角色啟示
- 品牌商 → 應辨識出已被歸類為獨立代碼的鄰近適應症。
- 新創 → 只要風險控制能對標現有基準,新創團隊也能以510(k)開創新產品代碼。
- 投資人 → 獲准新產品代碼 = 具備上漲潛力的「法規空白地帶」。
結論|IXI 循環的實踐
上述故事共同展示了 IXI 的「洞察與影響循環」:
- 認知 (Cognition):發現他人忽略的訊號。
- 決策 (Decision):在策略脈絡中詮釋資料。
- 行動 (Action):優先採取可轉化為競爭優勢的行動。
- 影響 (Impact):透過加速審批與市場准入來衡量經營成果。
每一項洞察都源於可驗證的 FDA 事實,然而,其真正的價值,是在串聯整個決策週期時才會浮現。
隨著醫療科技(MedTech)的競爭日益激烈,IXI 使領導者能洞察原始數據背後的意義——將法規表現與商業前瞻性連結起來。
邀請您共同開創決策的未來
若想探索本文中嵌入的互動式儀表板,歡迎加入 IXI MedTech Beta 計畫 (IXI MedTech Beta Program),與我們共同為醫療科技(MedTech)社群打造新世代的決策智慧。
👉立即加入IXI Beta計畫 → https://ixi-medtech.vercel.app/
即將推出 — 影響力導向系列 (The Impact-Driven Series)
我們的下一波內容將把這些洞察,轉化為針對醫材品牌商、新創公司和投資人等特定角色的系列文章 —— 具體展示「洞察與影響循環」中「影響力導向」的路徑。
延伸閱讀
- FDA 510(k) K250507 – Apple HTNF (product code: SFR) | Hypertension Notification Feature (HTNF) for Apple Watch
- FDA 510(k) DEN230003 (product code: QXO) | Viz.ai Viz HCM
- FDA 510(k) K243965 – Nerv Technology Origin™ (product code: SFO) | Origin™ Continuous pH and Flow Monitoring System
- FDA 510(k) K110416 product code: CHL) | Radiometer ABL835 FLEX analyzer
- 發掘FDA 510(k)資料潛能-RFM模型驅動醫材產業成長決策新思路 | Harnessing FDA 510(k) Data Potential: RFM Modeling – A New Paradigm for MedTech Growth Decisions
- 2025 Q2 FDA數據解析:AI影像軟體熱度攀升,市場競爭格局浮現 | Q2 2025 FDA Data Analysis: The Rise of AI Imaging Software & The Emerging Competitive Landscape
- IXI MedTech Beta Program → https://ixi-medtech.vercel.app/

